A AUGA, O LÍQUIDO MÁIS ESTRAÑO DO UNIVERSO

A auga, un líquido cargado de propiedades asombrosas / elagoradiario.com
Se os cubos de xeo afundísense en lugar de flotar, non nos causaría un gran trastorno; só habería que remover a bebida de cando en vez para que a parte superior arrefriásese. Salvo polo feito de que non habería bebida que remover nin ninguén para facelo, porque non existiría a vida na Terra. Ou, polo menos, os humanos non estariamos aquí.
A flotación do xeo é unha das rarezas da auga, unha substancia tan familiar que nos parece corrente, pero que non ten nada de ordinario. Tan diferentes son as súas propiedades do que cabería esperar da súa composición química, que comprender como a súa estrutura microscópica causa un comportamento tan singular é algo que “discutiuse intensamente durante máis de 100 anos e aínda non se resolveu”, como escribían nunha recente revisión os físicos Lars Pettersson e Anders Nilsson, da Universidade de Estocolmo (Suecia), e Richard Henchman, da Universidade de Manchester (Reino Unido).
Todo estudante sabe que as substancias se contraen ao arrefriarse e dilátanse ao quentarse, o que permitiu a invención do termómetro. Tamén a auga quente reduce o seu volume ao arrefriarse. Pero por baixo dos 4°C, ocorre algo extraordinario: comeza de novo a dilatarse, como sabe todo o que conxelou unha botella demasiado chea. O resultado é que o xeo é menos denso que a auga líquida e por iso frota, un fenómeno que xa interesou a Galileo Galilei, cando en 1612 razoaba que “o xeo debería ser máis ben auga rarificada que condensada”.
Pero que ocorrería de non ser así? Nos océanos, lagos e ríos, a capa flotante de xeo que se forma no inverno impide que escape a calor, mantendo en estado líquido a auga que xace debaixo. Se o xeo caese ao fondo, continuaría formándose máis cantidade ata que todo convertésese nunha gran masa sólida; a calor da superficie só lograría fundir unha delgada capa superior, o que imposibilitaría a evolución da vida complexa como hoxe coñecémola. Ademais do papel bioquímico crucial da auga, a bioloxía, a xeoloxía e a dinámica dos océanos foron fundamentais para facer da Terra un planeta habitable.

Nos océanos, lagos e ríos, a capa flotante de xeo impide que escape a calor, mantendo en estado líquido a auga que xace debaixo / Jay Mantri
Non é nin moito menos a única propiedade inusual da auga. Pola súa fórmula química, como óxido de hidróxeno (H2O), debería seguir a pauta que marcan o sulfuro de hidróxeno (H2S), seleniuro de hidróxeno (H2Se) ou telururo de hidróxeno (H2Te), compostos similares cos elementos que seguen ao osíxeno no seu grupo da táboa periódica. Se así fóra, a auga debería ferver por baixo de -80°C e conxelarse cara a -100°C. Por sorte para a vida terrestre, sabemos que non é así; de feito, a súa conxelación a 0°C e a súa ebulición a 100°C (á nosa presión atmosférica normal) non só confírenlle unha ampla franxa de temperaturas en estado líquido, senón que a converten na única substancia que nas condicións habitables da Terra pode atoparse en forma sólida, líquida e gasosa.
Do anterior pode intuírse que as propiedades aberrantes da auga son, como confirma o químico Martin Chaplin, profesor emérito da London South Bank University, “totalmente responsables” da existencia da vida na Terra. De feito, engade Nilsson, curiosamente “parece que a auga vólvese anómala ás temperaturas ás que normalmente existe a vida”. Pero a que clase de raro fenómeno físico-químico debemos agradecer a nosa existencia? Segundo Chaplin, “hai varias explicacións, pero ningunha delas demostrou ser concluínte ou plenamente inclusiva”. Na súa orixe están as peculiares características do osíxeno, un dos elementos máis electronegativos da táboa periódica. Ao combinarse co hidróxeno atrae os electróns cara a si con tal forza que a molécula de auga, aínda que eléctricamente neutra no seu conxunto, forma dous polos, negativo e positivo.

A auga pode actuar como lubricante e como adhesivo entre superficies / Pixabay
Este carácter dipolar da auga é clave, xa que permítelle formar ligazóns chamadas de ponte de hidróxeno. En comparación con outros compostos en aparencia similares, “a formación de pontes de hidróxeno na auga é moito máis forte e máis extensiva”, di Chaplin. Estas ligazóns confiren á auga un comportamento pegañento que é responsable da súa enorme tensión superficial (a maior nun líquido exceptuando o mercurio) e de que poida actuar ao mesmo tempo como lubricante e adhesivo entre superficies.
Son as estruturas microscópicas derivadas destas ligazóns, as cales á súa vez determinan as propiedades anómalas, as que aínda manteñen aos científicos inmersos en intensos debates. O xeo ten unha estrutura estable tetraédrica, cunha molécula de auga no centro unida por pontes de hidróxeno a outras catro nos vértices. Este ordenamento regular espazoso é o causante da baixa densidade da auga conxelada. Adoitaba pensarse que ao pasar ao estado líquido, esta estrutura simplemente volvíase máis dinámica, rompéndose e formándose pontes de hidróxeno a razón dun billón de veces por segundo, dando como resultado unha masa máis compacta.
Pero en 2004 Nilsson, Pettersson e os seus colaboradores descubriron que na auga líquida as moléculas tenden a abandonar a estrutura tetraédrica e a formar só dúas pontes de hidróxeno. “Propuxemos que a estrutura dominante está moi distorsionada”, di Nilsson. “Desde entón tamén postulamos que existen dous dominios estruturais fluctuantes, líquido de alta e de baixa densidade”. O modelo expón que a auga líquida non forma unha estrutura homoxénea, senón que é unha mestura de dous diferentes, unha tetraédrica lixeira e outra densa e desordenada que predomina a temperatura ambiente. Esta xorde cando o xeo desconxélase, aumentando a súa densidade, pero por encima de 4°C o aumento da forma densa induce unha repulsión entre as moléculas que resulta na dilatación térmica.
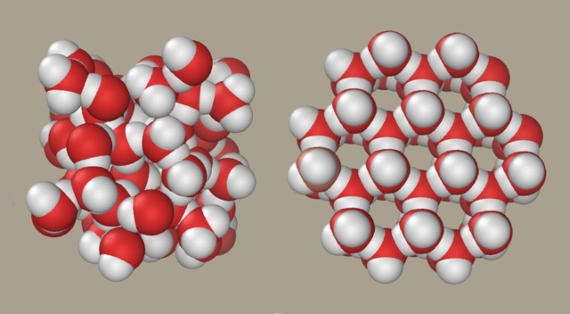
Auga líquida e xeo / P99am
Así, segundo o modelo de Nilsson e Pettersson, estas dúas estruturas diferentes e rapidamente cambiantes conviven no mesmo líquido nas condicións ambientais terrestres. A temperaturas ou presións extremas, a auga adopta só una das dúas configuracións e compórtase como un líquido calquera, sen esas rarezas que fan dela o líquido máis estraño do universo e ás cales debemos a nosa existencia.
FONTE: Javier Yanes/bbvaopenmind.com/ciencia
0 comentarios